Product category
多肽合成
( AAPPTEC公司原创文章,未经授权请勿转载,转载请注明出处,侵权必究。)
本文为非专业人士提供了有关多肽化学原理的战略考虑以及一般信息。这篇文章不是百科全书式的,而是专门讨论多肽合成的历史和基础。
多肽合成简史
“肽合成”包括一系列技术和程序,可以制备从小肽到大蛋白质的材料。布鲁斯·梅里菲尔德(Bruce Merrifield)引入了固相有机合成(SPPS)的开创性工作,从而极大地改变了多肽合成策略,并简化了与液相合成相关的繁琐而苛刻的纯化步骤。此外,梅里菲尔德的SPPS广泛地促进了自动化合成仪的发展。在定义合成策略并对氨基酸序列进行编程后,机器可以自动执行所有合成步骤来制备多个肽样本。SPPS现已成为生产肽的首选方法,尽管溶液相合成仍然可用于大规模生产给定肽。
肽化学是化学的一个分支学科,发展相当滞后。它的生长无法与芳香化合物化学的快速开花相提并论,芳香化合物化学始于1825年法拉第从煤气中分离苯,以及1865年A.Kekule提出其结构。这些发现为染料和药物制造奠定了基础,随后又为石油化学生产奠定了基础。肽化学史前史隐藏在早期蛋白质和生理化学的研究中,例如发现营养物质和血液成分之间的关系。
Hermann Emil Fischer和Ernest Fourneau在1901年报告了第一种肽合成以及术语“肽”。Fischer和Fourneau发表了通过将2,5-哌嗪二酮 (甘氨酸酐)和盐酸共沸合成制备了第一种双甘氨肽。
1902年在卡尔斯巴德的德国科学家和医生协会,Emil Fischer总结了从蛋白质水解物中分离氨基酸和肽的问题,并讨论了蛋白质中氨基酸的偶联。用他自己的话来说:“正如霍夫迈斯特在今天早上的一般性演讲中也假设的那样,很容易浮现出类酸酰胺类基团发挥主要作用的想法。”早在1900年,Fischer就开始了通过有机化学方法将氨基酸相互连接的实验。这两场讲座标志着所谓的Fischer-Hofmeister蛋白质结构理论的出现。Emil Fischer在与E. Foumeau的一篇论文中刚刚描述了第一个原型,glycyl-glycine,在他的讲座中还提出了多肽、二肽、三肽等和后来的多肽的名称。
Emil Fischer和他的同事在20世纪的第一个十年里,使用他的实验室开发的方法合成了大约100种肽,这些肽含有2到18个氨基酸残基。
Bergmann按照Fischer学派的思路,与Joseph S Fruton系统地恢复了肽的合成工作。弗鲁顿于1934年在他抵达洛克菲勒研究所后不久就加入伯格曼,他利用新的碳苯甲氧基方法的潜力合成了难以获得的肽,作为酶水解的底物进行测试。他和伯格曼发表了一种合成简单底物的文章,这些底物被木瓜蛋白酶、糜蛋白酶、胰蛋白酶和胃蛋白酶在某些肽键上切割。
多肽化学的历史长达一个多世纪,从二甘氨酸等简单的化合物到含有100多种氨基酸的酶。由于每种氨基酸的个体特性以及许多氨基酸组成大分子的组合,肽表现出极其多样的特定功能。它们可以作为化学信使、激素、细胞内或细胞间介质、高度特异性的刺激剂和抑制剂,以及大脑和神经系统中的生物活性肽。来自细菌、霉菌和两栖动物皮肤的许多抗生素化合物在本质上是消化性的,因此这些化合物不仅对病原体有毒,而且对高等生物的细胞也有毒。积极参与免疫系统反应的多肽正吸引着生物医学研究人员越来越多的关注。多肽科学仍在全面发展阶段。
多肽合成的基本原理和试剂
肽键的形成需要氨基酸羧基的激活,
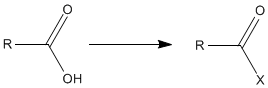
其中X是卤素、C(O)R或其他抽电子的原子或基团。羧酸、酸性氯化物或酸性酐的活性中间体是已知的,并在肽化学之前用于制备酰胺,但氨基和羧基具有保护作用。

保护基团(Y)不应该成为酰胺的一部分,并且长期以来一直存在问题。通过合成获得的第一批肽衍生物,苯乙酰甘氨酸和乙氧羰基甘氨酸乙酯携带阻塞基团,如果不破坏新形成的肽键,这些阻塞基团就无法去除。显然,对于多肽合成,需要易于移除的保护基团。1932年Bergmann和Zervas发现了苯氧羰基(Z或Cbz),这是解决这一问题的一个重大突破。
苯氧羰基可以在室温和普通压力下通过催化加氢去除,这个过程使肽键和各种侧链功能不受影响,并产生无害的副产品、甲苯和二氧化碳。
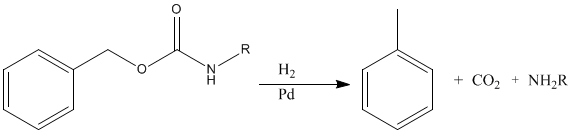
去保护可以在没有特殊设备或特殊技能的情况下进行,通常是定量的,这是最优雅的方法。
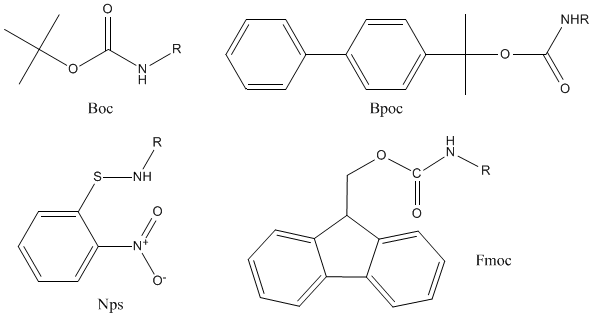
Z基团的去除促进了对酸敏感保护基团的进一步研究。这导致了一系列在温和条件下可切割的阻塞基团的发展。
例如,最重要的是叔丁基氧羰基(Boc)、邻硝基苯磺酰(Nps)和联苯异丙基氧羰基(Bpoc)。在Nps基团的情况下,亲核试剂的去保护似乎是一个有吸引力的替代方案。二胺对9-芴甲基氧羰基(Fmoc)基团的裂解在合成复肽中具有重要意义。
建立了羧基活化和偶联的新方法。一种经典的方法-叠氮化物法-仍然是肽化学中有价值的工具。曾经很重要的费雪酸氯化物法现在并不常用。
然而,通过酸酐的耦合在肽化学家中很受欢迎。由于用于激活受保护氨基酸的成分的变异性,许多研究人员提出混合或不对称酐,作为肽键形成的一般方法的不同版本。
使用异丙基、异丁基或秒丁基碳酸酐可以达到多肽的产量和纯度。
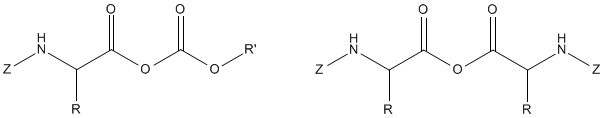
羧基可以通过将受保护氨基酸转化为活性酯来实现,其中R'是一个电子提取基团。
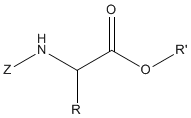
一些酯变得非常受欢迎,例如硝基苯酯、2,4,5-三氯苯酯、N-羟基琥珀酰亚酯和五氟苯酯。
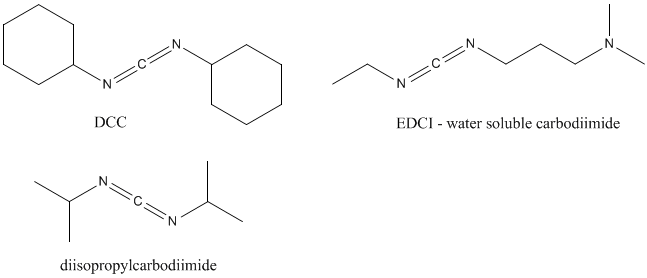
偶联试剂作为吸引性肽键形成方法用于肽合成。这些化合物可以被添加到部分受保护的氨基酸或具有游离羧基的肽的反应混合物中,以及具有游离氨基的第二种受保护的氨基酸或肽的反应混合物中。最成功的偶联试剂二环己基碳水化合物二酰亚胺(DCC或DCCI)由Sheehan和Hess于1955年引入。到目前为止,DCC、其水溶性衍生物(EDCI;1-乙基-3-(3-二甲基氨基丙基)碳二酰胺)和二异丙基碳水化合物二酰亚胺是铅偶联试剂。
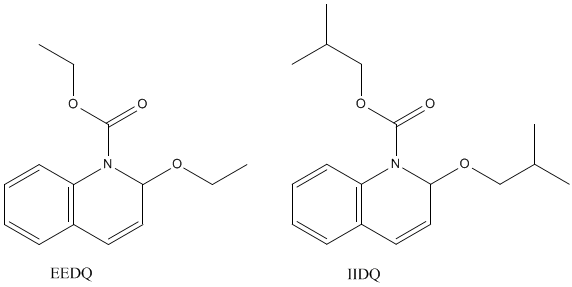
混合生成酸酐的化合物1-乙氧基羰基-2-乙氧基-1,2-二氢喹啉(EEDQ)和类似物-1 -异丁氧基羰基-2-异丁氧基-1,2-二氢喹啉(IIDQ)是有用的偶联试剂。它们易于制备,易于储存,很少引起外消旋作用或其他副反应。
大多数多肽合成都伴随着轻微的、不希望的副作用,多肽可能会受到副产品的污染。有一种解决方案可以避免副产品的形成。
固相多肽合成
多肽的合成比简单地通过在反应容器中混合所需的氨基酸来形成酰胺键要复杂得多。20种天然的和无穷无尽的非天然氨基酸提供了许多可能的组合。
在两种氨基酸混合在一起的溶液中,将形成四种不同的二肽以及其他较长肽,例如,在甘氨酸和丙氨酸的混合物中,四种二肽将是Gly-Gly、Gly-Ala、Ala-Gly和Ala-Ala。
固相多肽合成是为了提供快速、简化和有效的制备多肽和小蛋白质的方法而发展起来的(Merrifield,1963年)。
为了确保形成所需的肽,必须使氨基酸的碱性基团和另一个氨基酸的酸性基团都无法反应。这种“失活”被称为对反应基团的保护。无法做出反应的基团被称为保护基团。
在经典有机合成中,酸受到保护,允许发生反应和去保护。之后,肽的一端受到保护,并允许与新的受保护的酸发生反应等。在固相多肽合成(SPPS)中,一个肽端附着在不溶于水的聚合物上,并在整个肽形成过程中保持保护,这意味着更少的步骤和简化的纯化,试剂可以冲洗掉而不丢失肽。
固相肽合成涉及以下步骤:将氨基酸附着在聚合物上、保护、偶联、去保护和去除聚合物。
将氨基酸附着在聚合物上
附着是通过氨基酸与连接剂反应,再与聚合物连接另一端。形成了肽-聚酰胺链接,并且在随后的肽形成反应中不会被水解。常见的连接剂是二取代苯和三取代苯,如下所示。
这些与C端氨基酸和树脂一起形成以下聚合物结构。
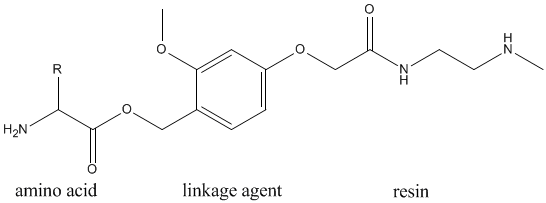
保护
下一个氨基酸需要保护其氨基,以防止酸相互反应。FMOC(9-氟苯基甲氧基羰基)是一种优良的保护基团。此外,任何含有芳香、酸、碱基和/或极性基团的氨基酸侧链都可能具有活性。它们必须受到保护,以防止不必要的分链形成。这种方法使用四种主要基团,叔丁基(tBu)、三苯基甲基(Trt)、叔丁基羰基(tBOC)和2,2,5,7,8-五甲基铬-6-磺酰基(PMC)。
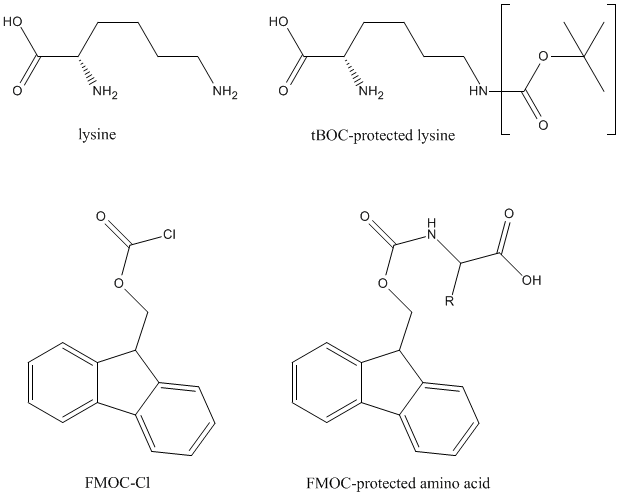
偶联
受FMOC保护的氨基酸与附着在聚酰胺上的最后一个氨基酸发生反应。该反应由DCC(N,N'-双环己基碳二酰亚胺)催化。
脱保护
多余的DCC用水冲洗掉。用哌啶(二级环胺)去除FMOC基团。酸保护基团被从链上移除,并能够添加另一个酸分子。在第二步,一个新的氨基酸被保护起来。循环过程继续进行,直到完成所需的链长。
聚合物去除
一旦所需的肽完成,必须从聚酰胺中去除。它可以通过使用95%的三氟乙酸(TFA)溶液来实现。侧链保护基团也在此阶段被移除。
SPPS的优缺点
SPPS的主要优点是多肽产量高。由于多肽由多种氨基酸组成,每种酸的收率都小于100%,所以多肽的总收率可以忽略不计。例如,如果每个氨基酸提供90%,那么含有100个氨基酸的肽的总收率仅为0.003%。
固相多肽的合成比经典液相法快得多。SPPS允许在24小时内形成20个氨基酸肽,并在不到一周的时间内形成更长的氨基酸肽。
随着现代自动合成仪和复杂的分析和纯化设备的改进,多肽化学家可以制造长度在20-50个氨基酸之间,总量在20-100毫克之间。
SPPS的基本优势是高效地将中间体与起始材料、试剂和大多数副产品分离。附着在不溶性聚合物上的肽在溶剂处理过程中保持不溶解。
SPPS的另一个优点是不需要费时地通过萃取或结晶分离中间体。为大分子量中间体寻找溶剂的问题已经不存在了,因为使用聚合物膨胀的溶剂就足够了。
将氨基盐转化为游离胺相当简单,只需用叔碱处理肽基树脂,然后用水洗去除形成的烷基铵盐。
SPPS最大的缺点是中间体无法被纯化,对其进行表征的可能性相当有限。
然而,已经有许多自动执行SPPS的仪器设备出现在市场上面,并且开发了多种用于肽构建的连续分析控制的方法。
参考文献
1. M. Bodanszky. Principles of Peptide Synthesis, 2nd ed., Springer,
Heidelberg, 1993. [Book].
2. Bernd Gutte. Peptides: Synthesis, Structures, and Applications. Academic
Press; 1 edition (November 2, 1995). [Book].
3. Gregg B. Fields. Introduction to Peptide Synthesis. Current Protocols in Protein
Science. [Article].
4. T. Wieland, M. Bodanszky. The World of Peptides. A Brief History of Peptide
Chemistry. [Book].
5. Fields GB, Noble RL. Solid phase peptide synthesis utilizing
9-fluorenylmethoxycarbonyl amino acids. Int J Pept Protein Res. 1990;
35:161–214. [Article].
6. Merrifield B. Solid phase synthesis. Science. 1986; 232:341–347.
[Article].
AAPPTEC的使命是始终以有竞争力的价格提供高质量的多肽合成仪、氨基酸和试剂,生产出高质量的粗肽!
( AAPPTEC公司原创文章,未经授权请勿转载,转载请注明出处,侵权必究。)
联系我们
AAPPTEC爱谱肽客多肽合成仪 公司地址:北京市海淀区芙蓉里南街6号扫一扫 更多精彩

微信二维码

网站二维码