Product category
( AAPPTEC公司原创文章,未经授权请勿转载,转载请注明出处,侵权必究。)
蛋白质本身相对简单。然而,在考虑化学反应和蛋白质特定结构和功能的连通性时,构成蛋白质的各种亚结构和元素是错综复杂的。
蛋白质是有机化合物,含有四种元素:氮、碳、氢和氧。为了掌握蛋白质的整体,了解蛋白质的基本生物分子、多肽、多肽链、氨基酸、蛋白质结构和蛋白质变性过程等各种性质是很重要的。
蛋白质基础知识
蛋白质是生物系统中最丰富的有机分子之一,与其他类别的大分子相比,蛋白质在结构和功能上非常多样化。即使一个细胞也含有数千种蛋白质,这些蛋白质以各种方式发挥作用。蛋白质由20种不同的氨基酸组成,基因组决定了特定的氨基酸及其序列。
因此,由于长期进化蛋白质的复杂结构和功能特性,蛋白质活性和功能的差异会发生变化。这些属性包括:
1. 蛋白质快速折叠的过程。
2. 特定于小分子群的结合位点。
3. 平衡结构的灵活性和刚性水平,以维持蛋白质的功能。
4. 与蛋白质环境相适应的蛋白质表面结构。
5. 蛋白质易受降解会造成损害,从而使蛋白质变得毫无用处。
所有生物体中存在的蛋白质中都含有几种结构材料。与这些结构相关的许多不同功能是:
• 催化
-增加蛋白质(例如酶)内部化学反应的速率。
• 结构
– 增强骨骼、肌腱和皮肤(如胶原蛋白)。
• 运动
- 肌肉收缩允许运动(例如肌球蛋白)。
•新陈代谢调节
- 连接或获取细胞所需的生物分子。
• 运输
– 将氧气输送到整个身体中(例如血红蛋白)。
• 防御
– 蛋白质抗体可以防止外来病原体(如免疫球蛋白)。
蛋白质以不同的形状和结构形成。一些蛋白质是球状的(球形的)、紧凑的和水溶性的,而另一些蛋白质是纤维状的和细长的,物理上坚韧的,不溶于水的。化学键是蛋白质保持形状的原因。
4级蛋白质结构
四级不同的蛋白质结构会影响特定的蛋白质活性。不同的氨基酸序列形成不同的形状,因此形成不同的蛋白质。所有蛋白质活性都基于以下四级结构:
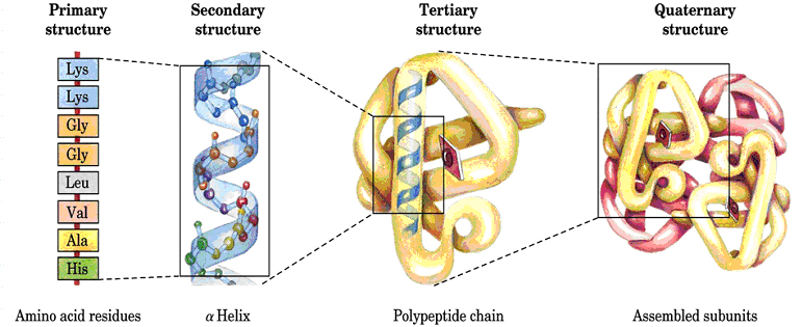
一级结构:蛋白质的主要结构是其氨基酸序列。基因代码的碱基(重复)序列由三种氨基酸(甘氨酸;脯氨酸;“x”-任何其他氨基酸)组成。这种氨基酸序列结合在一起,形成多肽(多=许多)键或链。蛋白质的主要结构是线性的。
二级结构:多肽链的主链骨架本身(不包括R基团)在空间上有规律的折叠和盘绕。这些部分相互吸引,形成具有α(α)螺旋和β(β)褶片的结构。是由氨基酸残基非侧链基团之间的氢键决定的。这些二级结构蛋白质包含圆柱形区域(α螺旋、螺旋形状)和/或平面区域(β倍增片、带峰和谷的带状)。二级结构是三维的。
三级结构:是指多肽链在二级结构的基础上,进一步盘绕、卷曲和折叠,形成主要通过氨基酸侧链以次级键以及二硫键维系的完整的三维结构。氢键稳定了折叠的发生。稳定折叠过程的其他分子内键包括疏水相互作用、离子键和二硫化物桥。这些键是在氨基酸的R基团之间形成的。它们含有蛋白质的非极性部分,这些部分会导致吸引和排斥,并盘绕在一个区域,形成一个非常复杂的结构。三级结构是蛋白质的整体形状,其中大多数是球状的,或纤维状的-长而细。
四级结构:当两个或多个三级多肽链形成单个或完整的蛋白质时,就形成了四级结构。某些蛋白质可能具有非多肽结构,因此属于假体基团,而其他蛋白质是偶联的。在这里,通过氢键形成独特的模式。
深入了解多肽
蛋白质一词是指含有多于50个氨基酸组合的分子。每个蛋白质都包含一个或多个多肽链。氨基酸的化学性质和顺序决定了多肽的结构和功能。这些多肽链中的每条都由氨基酸组成,氨基酸以细致的、周密的和特定的顺序连接在一起。多肽的分子量从几千到数百万道尔顿不等。分子量较低的(小于50个氨基酸)被归类为多肽。
多肽的氨基酸通过相邻的共价键(肽键)链连接在一起。反过来,每个键在脱水合成(缩合)反应中形成。在整个蛋白质合成过程中,氨基酸的羧基与传入氨基酸的氨基反应,释放出水分子。这个过程发生在不断增长的多肽链的末端,从而导致氨基酸之间的键,称为肽(或多肽)链。
多肽链有两端,在化学性质上彼此不同。这是由于氨基酸,它们产生链的方向性。多肽链的两端由以下部分组成:
• 游离氨基团,即氨基末端(N端)。
• 游离羧基(C端)。
• 每个末端都位于另一个的另一端。
除了多肽键外,硫化物桥形成和席夫碱基层是由氨基酸“指导”的细胞活动期间可能发生的另外两种化学反应,氨基酸构成了所有蛋白质的基础。
蛋白质中的化学键
氨基酸的相互作用导致蛋白质折叠成成熟的形状(三级)。这种折叠的发生是因为氨基酸内的键旋转,以及连接各种氨基酸的键。
羰基碳和氮之间形成肽键,氮是另一种肽键。氮与羰基碳结合,然后与肽链结合,再回到氮上,如此循环。从链上看,骨架正在相互作用。此外,氮具有电负性的,因此它会消耗了氮的电子。在这里,氢具有部分正电荷。
相反,氧气是电负性的。氧气从碳中夺取电子,使氧气具有部分负电荷。简而言之,氢和氧相互吸引,形成氢键。从那里,这两个连接的链形成一个β褶片。然后,骨架相互作用,并朝着同一方向移动,这被称为平行β褶片。
β褶片呈现某种模式,按氮、α碳和羰基碳的顺序移动。它在蛋白质的左侧。右侧是按羰基碳、α碳和氮的顺序移动。请注意,这两个过程的方向是相反的,氢键在这两个部分带正电的氮-氢键两端之间的氢键留在氢端。氢键和主链仍然是平行的,但是它们移动的方向不同。这被称为反平行β褶片,这是另一种形式的二级结构。
蛋白质的主干也可以成为螺旋结构(也是二级结构),在螺旋的不同层之间形成氢键。请记住,氧带部分负电荷,氢带部分正电荷。无论如何,由此产生的氢键使蛋白质具有螺旋结构。因此,这些相互作用突出了创造蛋白质结构、动力学和功能的深入和相互关系的过程。
所有蛋白质都有上述共同的过程,但并非所有蛋白质都具有更复杂和相互作用的三级和四级结构。几种分子相互作用和热力学变化可以在这些高度复杂的蛋白质分子结构中发生。
蛋白质变性
当蛋白质的三维结构(二级、三级或有时是四级结构)发生变化时,就会发生蛋白质变性。变性使蛋白质失去功能,或至少无法履行其通常的功能。然而,肽链在变性后完好无损,蛋白质的化学性质也是如此。通常,变性过程是不可逆的。
热、冷或不利的pH值等因素都可能导致蛋白质变性,导致肽键分子结构之间的损伤,从而破坏原本共价键。«健康的»蛋白质相互折叠,但变性会导致它们散开。
要了解高温和高或低pH值等因素是如何导致变性,重要的是要记住,氢键在蛋白质的二级、三级结构中,有时甚至是四级结构中至关重要。氢键是一种肽键。碳、氧和氮在上述蛋白质结构中同样重要。
例如,过热会导致功能分子基团的扭曲、弯曲和旋转,并且由于已知氢是脆弱的,因此更容易破裂。温度升高破坏了现有的氢键以及其他非极性疏水相互作用。随着温度的升高,动能也会升高。这导致蛋白质的分子成分振动,从而导致键断裂。这反过来又会造成附近任何氢键破裂或断裂的模式。
参考文献
1. Hegyi H, Bork P. On the classification and evolution of protein modules. J Protein Chem. 1997 Jul;16(5):545-51. [PubMed].
2. A. D. Mclachlan. Protein Structure and Function. Annu. Rev. Phys. Chem. 1972.23:165-192.
3. Jay R. Hoffman, Michael J. Falvo. Protein - Which is Best? J Sports Sci Med. 2004 Sep; 3(3): 118-130. [PubMed].
4. Kent SB. Total chemical synthesis of proteins. Chem Soc Rev. 2009 Feb;38(2):338-51. [PubMed].
AAPPTEC的使命是始终以有竞争力的价格提供高质量的多肽合成仪、氨基酸和试剂,生产出高质量的粗肽!
( AAPPTEC公司原创文章,未经授权请勿转载,转载请注明出处,侵权必究。)
联系我们
AAPPTEC爱谱肽客多肽合成仪 公司地址:北京市海淀区芙蓉里南街6号扫一扫 更多精彩

微信二维码

网站二维码